Le Test Génétique Préimplantatoire (PGT) permet de détecter des maladies graves causés par des altérations génétiques et évite sa transmission à la descendance, grâce à l’analyse des embryons avant son implantation, afin que les enfants naissent sans maladies héréditaires.


Le Test Génétique Préimplantatoire (PGT, abréviation en anglais) détecte des altérations génétiques et chromosomiques de l’embryon avant de le transférer dans l’utérus afin de prévenir la transmission aux enfants de maladies héréditaires graves et d’éviter le transfert d’embryons qui ne donneraient pas lieu à une naissance. Il existe trois variantes de PGT, selon l’altération à détecter.
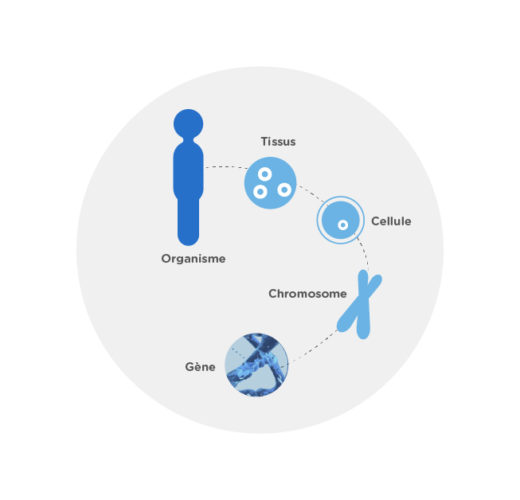
Les chromosomes sont des éléments présents dans le noyau des cellules. Ils sont le support de l’information génétique, notre ADN. Les gènes sont, à leur tour, des segments d’ADN qui contiennent de l’information sur le fonctionnement des cellules de notre organisme. L’être humain a 23 paires de chromosomes : 22 autosomes et une paire de chromosomes sexuels (XX chez les femmes et XY chez les hommes). Au moment où un spermatozoïde féconde un ovule, chacun des parents apporte un chromosome de chaque paire. Ainsi se transmet notre patrimoine génétique.
Cependant, certains changements peuvent causer une altération chromosomique. Il existe deux types de changements : de nombre –lorsqu’un chromosome complet est absent ou en trop- et de structure –lorsqu’un fragment de chromosome est absent ou en trop, lorsqu’il s’est transféré vers un autre chromosome ou lorsqu’il s’est retourné. Dans d’autres cas, l’altération a lieu dans un gène spécifique et trouble le fonctionnement de l’organisme, tout en provoquant une maladie. Ces maladies peuvent être transmises aux enfants de plusieurs façons

RÉSULTATS
90% des patientes qui suivent un traitement de procréation chez IVI tombent enceintes.
ASSISTANCE
97% de nos patients recommandent IVI.
IVI propose une assistance personnalisée sur mesure et un accompagnement pendant toutes les étapes du traitement.
TECHNOLOGIE
IVI est toujours à l’avant-garde des technologies de procréation assistée afin de pouvoir offrir les meilleurs résultats.
QUALITÉ-PRIX
Nous ne sommes pas les plus chers. Nous vous proposons le plus grand nombre de traitements possibles pour parvenir aux meilleurs résultats.
Il permet de détecter si les embryons ont des chromosomes absents ou en trop, c’est-à-dire s’ils ont des altérations numériques. Par exemple, le syndrome de Down est provoqué par la présence surnuméraire pour la 21e paire (trisomie 21). D’autres aneuploïdies chromosomiques pouvant causer des maladies sont la trisomie 18, la trisomie 13, 45X (syndrome de Turner), 47XXY (syndrome de Klinefelter), 47XYY et 47XXX.
Conseillé dans les cas suivants:
Le nombre de chromosomes de cette cellule (caryotype) est normal, un total de 46 divisés en 23 paires : 22 paires d’autosomes et 1 paire de chromosomes sexuels, XX pour la femme et XY pour l’homme.
Cependant, le nombre de chromosomes de cette cellule est altéré. Au lieu de 46 chromosomes elle en a 47, car la paire 21 a trois exemplaires au lieu de deux, ce qui correspond au syndrome de Down.
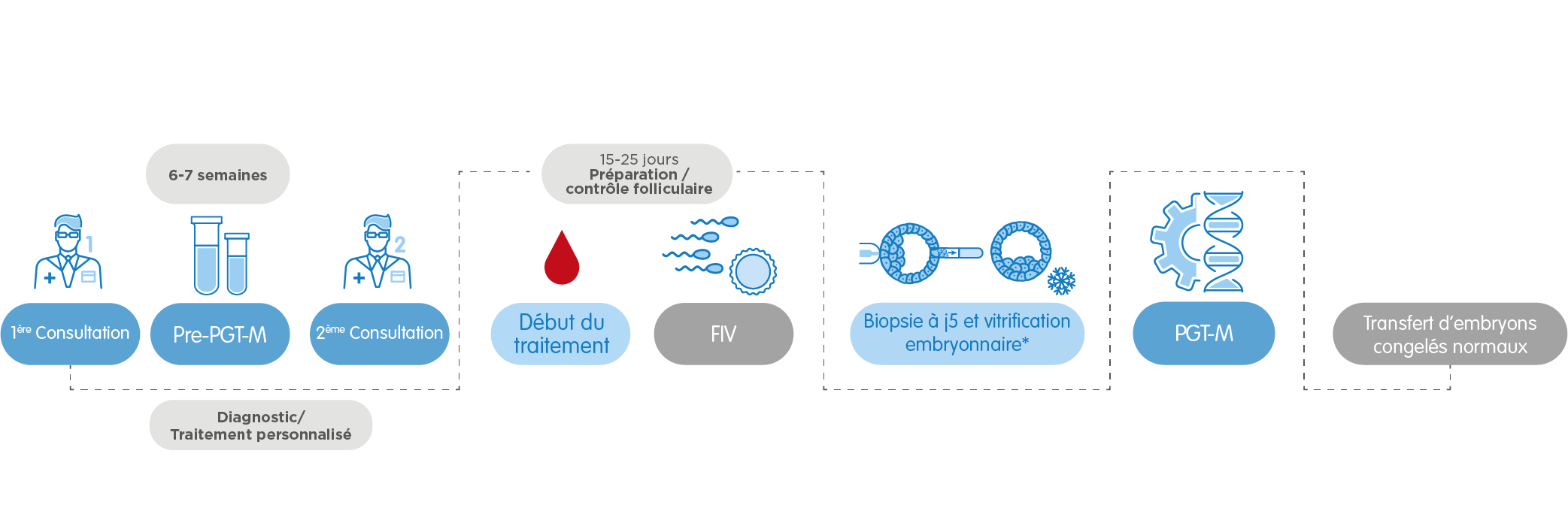
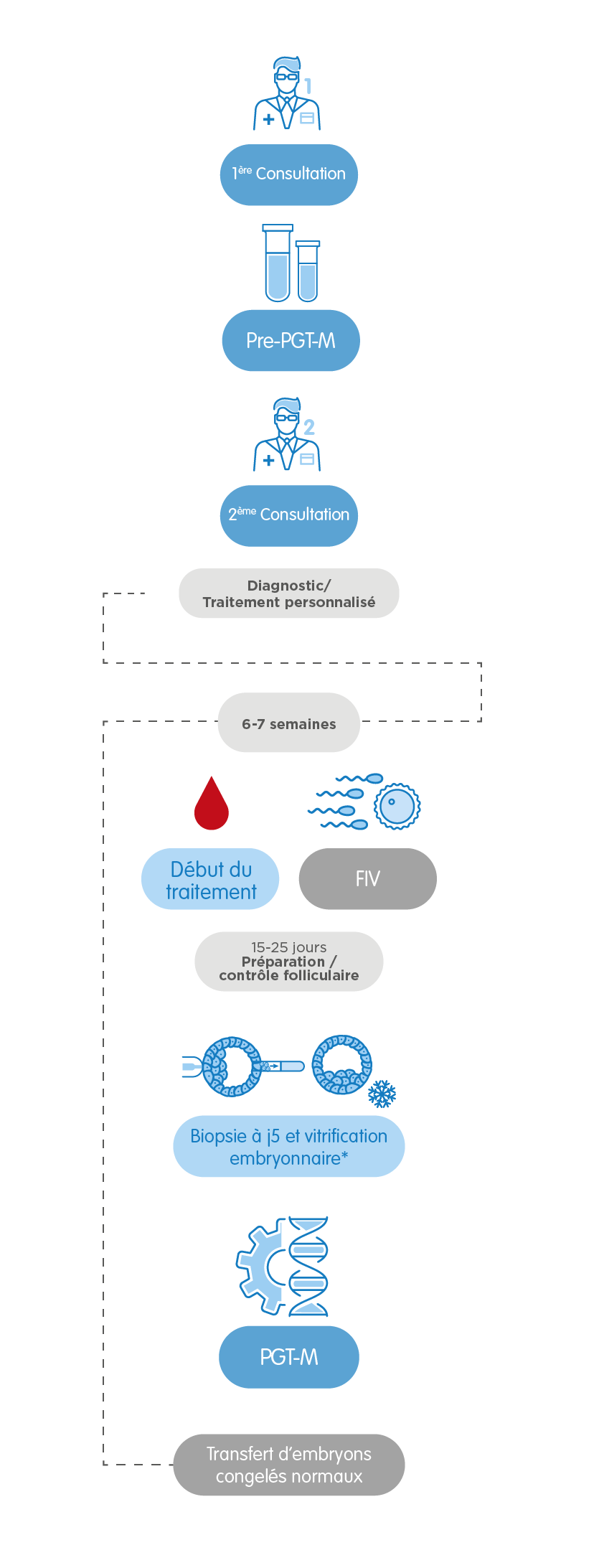
2. PGT-M, le Test Génétique Préimplantatoire pour dépister des maladies monogéniques
Il permet de détecter une altération ou mutation d’un gène spécifique chez les embryons pouvant provoquer une maladie monogénique ou mendélienne. Ce test analyse plusieurs types de maladies héréditaires –autosomiques récessives, autosomiques dominantes et des maladies liées au chromosome X-, comme la mucoviscidose, la maladie de Huntington, le Syndrome de l’X fragile, l’hémophilie A, l’anémie falciforme et la maladie de Marfan.
Conseillé dans les cas suivants:
Dans le cas des maladies autosomiques dominantes, l’un des parents a un gène affecté et il est atteint par la maladie (par exemple, l’homme). La femme n’a pas ce gène-là affecté. 50% de leurs enfants ne seront pas touchés par la maladie, et l’autre 50% auront le gène muté et seront donc atteints.
Par contre, dans le cas des maladies autosomiques récessives, avoir un seul exemplaire altéré du gène ne veut pas dire être malade, mais porteur. Pour être atteint, il faut que les deux exemplaires, celui du père et celui de la mère, aient le gène muté. Dans ce cas-là, 25% des enfants sera sain, 50% porteur sain et seulement 25% sera malade.
3. PGT-SR, le Test Génétique Préimplantatoire pour dépister des altérations de structure
Il permet de détecter la présence de chromosomes anormaux à cause d’une cassure ou de l’union incorrecte de plusieurs fragments. Il existe plusieurs types d’anomalies chromosomiques de structure –translocation, délétion, duplication, insertion, anneau et inversion. Dans certaines occasions elles peuvent être compensées (équilibrées) ou pas (déséquilibrées). Lorsque l’altération de la structure du chromosome ne laisse pas le gène s’exprimer correctement, cela provoque une maladie
Conseillé dans les cas suivants:
Anomalies chromosomiques de structure:
Translocation: s’il y a cassures et recollements des fragments des chromosomes. S’il n’y a pas de perte ou de gain de matériel génétique, ils peuvent poursuivre leur fonctionnement : elle est équilibrée.
L’exemple suivant affiche deux fragments de deux chromosomes qui se cassent et s’échangent. S’il y a perte et/ou gain de matériel génétique, elle est déséquilibrée.
Le dernier exemple affiche une fusion de deux chromosomes acrocentriques (ils ont un seul bras) par leur bout. Ceci augmente le risque de trisomie des chromosomes concernés.
Délétions: perte d’une partie du chromosome lorsqu’elle se casse et essaie de se réarranger. Elles peuvent aboutir à une perte de matériel génétique.
Duplications: un fragment de chromosome se duplique. Elles impliquent un gain de matériel génétique dans cette région.
Insertions: Un fragment de chromosome se casse et se réinsère sur un autre chromosome
Anneaux: un fragment des deux chromosomes se casse sur les extrémités et essaie de se réparer en les recollant, ce qui aboutit à une structure annulaire. Cette réparation implique la perte de deux fragments. Les gènes de ce chromosome ne fonctionnent pas correctement, ce qui provoque une maladie
Inversions: elles résultent de la cassure d’un fragment de chromosome, suivie d’une rotation de ce même fragment, puis de sa réintégration dans le chromosome. Selon le type d’union, cette rupture peut être réparée (équilibrée) ou pas.
Chaque PGT a ses particularités, mais tous ont besoin d’un cycle de fécondation in vitro afin de pouvoir analyser génétiquement les embryons résultants.
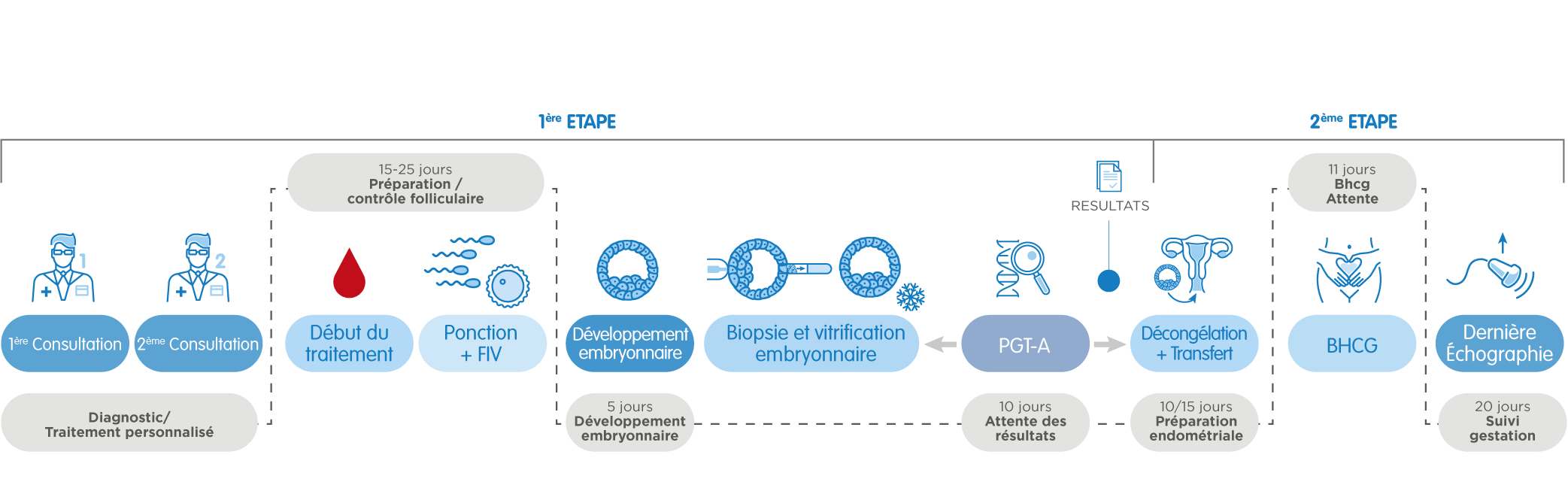
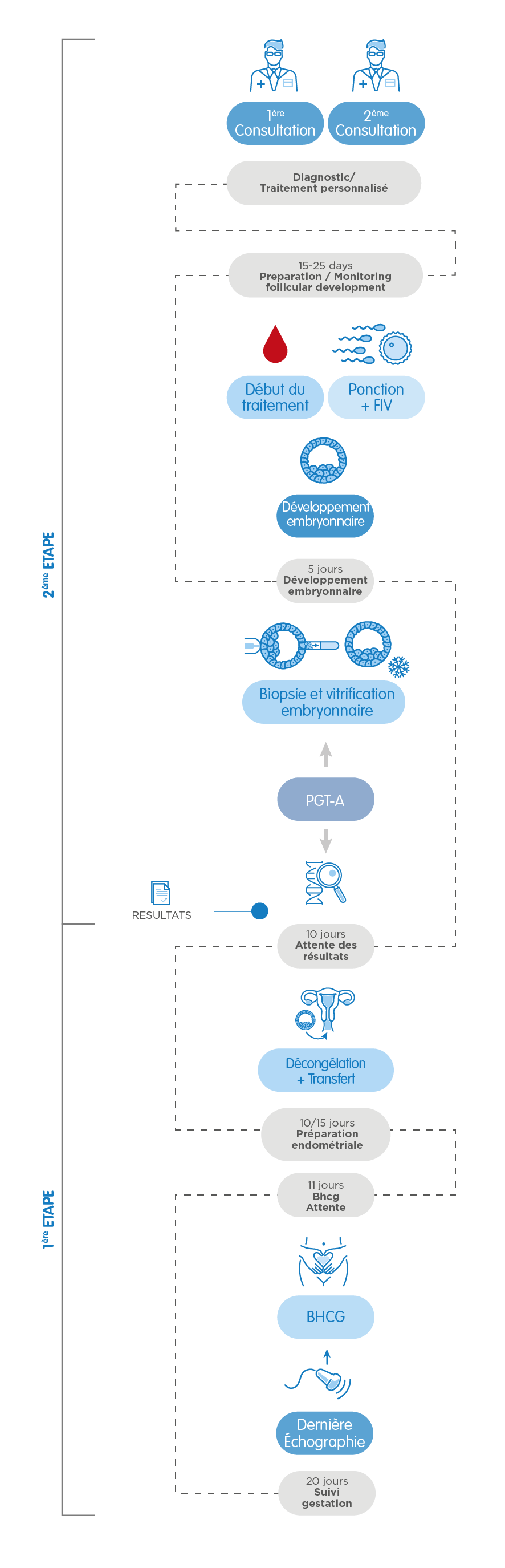
Après le premier rendez-vous avec le gynécologue, le traitement débute avec les règles. Au bout de 15-25 jours de stimulation ovarienne contrôlée, nous obtenons les ovocytes (ponction folliculaire). Une fois fécondés avec le sperme d’un donneur ou du partenaire, les embryons restent en culture jusqu’au stade de blastocyste, c’est-à-dire jusqu’à j5 ou 6 après la ponction.
Ensuite, nous prélevons un petit nombre de cellules de chacun des embryons –cette technique s’appelle biopsie embryonnaire-, et nous les traitons pour les analyser génétiquement. Le même jour nous congelons (vitrifions) les embryons biopsiés en attendant les résultats.
Une fois les résultats obtenus –la date varie selon le type de test: 10 jours pour le PGT-A ; 10-15 jours pour le PGT-SR et le PGT-M- nous préparons l’utérus de la patiente pour le transfert. Lorsque nous savons quels embryons sont aptes pour le transfert (c’est-à-dire, s’ils sont chromosomiquement normaux et/ou ne sont pas atteints de la maladie génétique analysée), nous dévitrifions l’un d’eux et le transférons dans l’utérus maternel. Les embryons surnuméraires normaux restent congelés et ils peuvent être utilisés ultérieurement.
Dans le cas spécifique du PGT-SR, pour le dépistage d’altérations de structure, nous pouvons avoir besoin d’une étude préalable de la translocation, qui prend de 30 à 60 jours selon le type d’altération chromosomique. Le reste du procédé est très similaire.
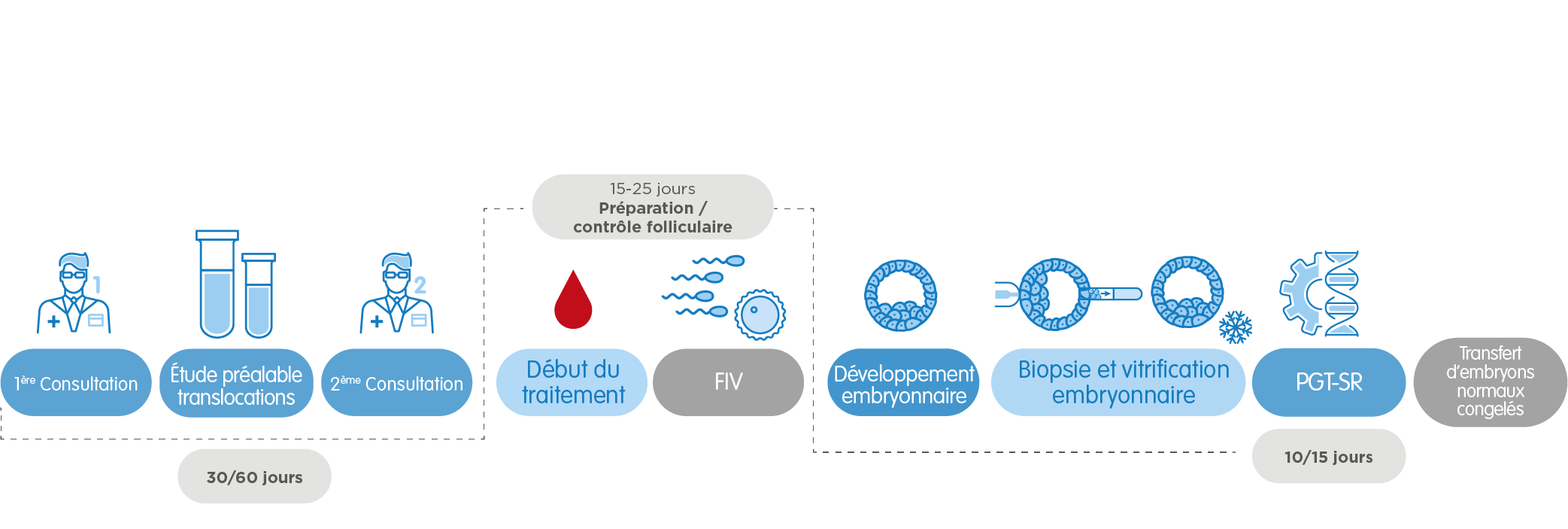
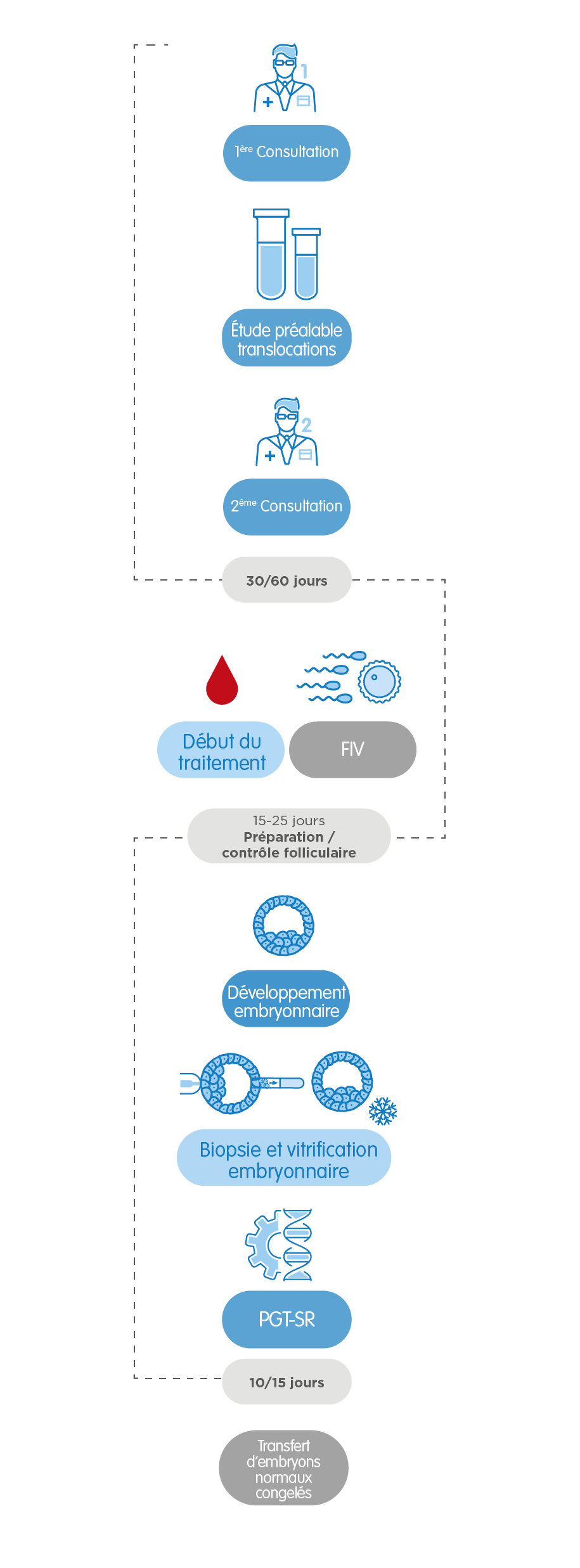
Enfin, dans le cas du PGT-M pour le dépistage de maladies monogéniques, il faut une étude préalable d’informativité qui nous apporte de l’information sur comment procéder dans chaque cas. La durée de cette étape varie selon le type de gène altéré, entre 6 semaines et 4 mois. Nous pouvons avoir besoin de préparer un protocole spécifique pour la maladie à dépister. Ceci peut prolonger le processus jusqu’à 3 mois. Dans tous les cas, nos professionnels orienteront à tout moment nos patients pour qu’ils puissent suivre le processus avec la plus grande assurance et en recevant un traitement personnalisé.